Monografía de los Modelos Atómicos: Historia, Tipos y Relevancia en la Ciencia
Introducción a los Modelos Atómicos
Cuando pensamos en la estructura del universo, a menudo nos viene a la mente la vasta inmensidad del espacio, las estrellas brillantes y los planetas que giran a su alrededor. Pero, ¿alguna vez te has detenido a pensar en lo que compone esas estrellas y planetas? Todo, absolutamente todo, está hecho de átomos. Desde el aire que respiramos hasta el agua que bebemos, los átomos son la base de la materia. La historia de los modelos atómicos es fascinante y se remonta a miles de años. A través de los siglos, científicos y filósofos han intentado desentrañar el misterio de la materia, desarrollando diversas teorías que han evolucionado con el tiempo. En este artículo, exploraremos la historia de los modelos atómicos, los diferentes tipos que han surgido y su relevancia en la ciencia moderna. ¡Prepárate para un viaje alucinante al corazón de la materia!
Un Viaje a Través del Tiempo: Historia de los Modelos Atómicos
Los Primeros Pensadores: Demócrito y la Idea de lo Indivisible
La historia de los modelos atómicos comienza con el filósofo griego Demócrito, quien, en el siglo V a.C., propuso que todo en el universo estaba compuesto de pequeñas partículas indivisibles que llamó «átomos». Imagina que cada objeto que ves es como un rompecabezas gigante, y los átomos son las piezas que lo componen. Aunque su idea fue revolucionaria, no contaba con evidencia experimental para respaldarla, lo que llevó a que muchos la ignoraran. Sin embargo, esta noción de que todo está hecho de partes más pequeñas sentó las bases para el desarrollo de la química y la física.
La Teoría Atómica de John Dalton
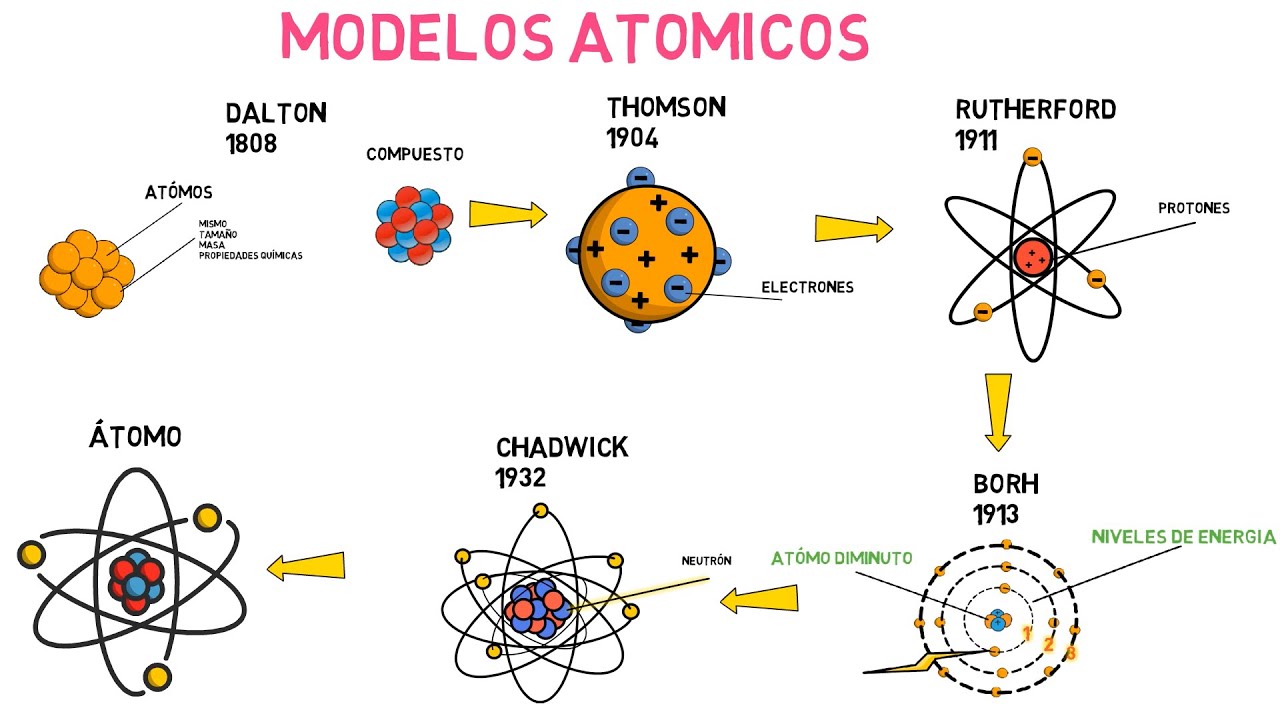
Avancemos un par de milenios hasta el siglo XIX, donde encontramos a John Dalton, un químico inglés que, a principios de 1800, propuso una teoría atómica más estructurada. Dalton no solo retomó la idea de Demócrito, sino que también la amplió, sugiriendo que los átomos de diferentes elementos tienen diferentes masas y propiedades. ¿Te imaginas? Cada elemento, como el oxígeno y el hidrógeno, tiene su propia «personalidad» atómica. Esto fue un gran avance, ya que permitió a los científicos empezar a clasificar y entender los elementos químicos de manera más sistemática.
Modelos Atómicos en el Siglo XX: De Thomson a Bohr
El Modelo de Thomson: El Pudín de Pasas
En 1897, J.J. Thomson hizo un descubrimiento asombroso: los electrones. Su modelo atómico, conocido como el «modelo del pudín de pasas», imaginaba un átomo como una esfera positiva con electrones incrustados en ella, similar a las pasas en un pudín. Aunque su imagen era bastante simplista, marcó un paso crucial en la comprensión de la estructura atómica. A pesar de que no era completamente precisa, esta idea abrió la puerta a nuevas investigaciones sobre la naturaleza de los átomos.
El Modelo de Rutherford: El Núcleo y los Electrones en Órbita
Luego llegó Ernest Rutherford, quien, a través de sus experimentos con partículas alfa, descubrió que los átomos tienen un núcleo denso y positivo en su centro, rodeado de electrones que giran a su alrededor. Imagina un sistema solar en miniatura, donde el núcleo es el sol y los electrones son los planetas. Este modelo fue un gran avance, pero aún dejaba muchas preguntas sin respuesta sobre la estabilidad de los electrones en sus órbitas.
El Modelo de Bohr: Órbitas Cuantizadas
En 1913, Niels Bohr revolucionó aún más el modelo atómico al proponer que los electrones no solo giran alrededor del núcleo, sino que lo hacen en órbitas específicas y cuantizadas. ¿Qué significa esto? Bueno, es como si los electrones tuvieran «carriles» en los que pueden moverse, pero no pueden estar en cualquier lugar entre esos carriles. Este modelo no solo explicó la estabilidad de los átomos, sino que también ayudó a entender la emisión de luz en los átomos, un fenómeno que se relaciona con los espectros atómicos.
Modelos Atómicos Modernos: La Mecánica Cuántica
El Modelo Cuántico: Probabilidades y Nubes Electrónicas
Con el avance de la mecánica cuántica en el siglo XX, la visión del átomo cambió drásticamente. El modelo cuántico, que surgió gracias a científicos como Schrödinger y Heisenberg, introdujo la idea de que no podemos conocer la posición exacta de un electrón, sino solo la probabilidad de encontrarlo en un lugar determinado. En lugar de órbitas fijas, ahora hablamos de «nubes electrónicas». Imagina que en lugar de ver un camino claro, estás observando una niebla donde los electrones pueden aparecer en diferentes lugares. Esto representa una forma más precisa de entender el comportamiento de los electrones en un átomo.
La Importancia de la Interacción entre Partículas
Además, el modelo cuántico introdujo la idea de que los electrones pueden comportarse como partículas y ondas. Esto significa que pueden interferir entre sí, creando patrones de ondas que son fundamentales para entender fenómenos como la química y la física del estado sólido. Así que, si alguna vez te has preguntado por qué algunos materiales son conductores de electricidad y otros no, la respuesta está en cómo interactúan sus electrones a nivel cuántico.
La Relevancia de los Modelos Atómicos en la Ciencia Actual
Avances en Química y Materiales
La comprensión de los modelos atómicos ha sido fundamental para el avance de la química moderna. Gracias a ellos, podemos predecir cómo reaccionan los elementos entre sí y desarrollar nuevos compuestos. Por ejemplo, la creación de nuevos materiales, como los semiconductores, se basa en la manipulación de electrones a nivel atómico. ¿Te imaginas un mundo sin tecnología moderna? La electrónica, la medicina y la energía dependen de estos principios atómicos.
La Física y la Energía Nuclear
Además, en el campo de la física, los modelos atómicos son esenciales para entender la energía nuclear. La fisión y fusión nuclear, procesos que liberan enormes cantidades de energía, se basan en la interacción de los núcleos atómicos. Sin el entendimiento profundo que hemos desarrollado sobre los átomos, no tendríamos acceso a fuentes de energía que han cambiado el curso de la historia.
Reflexiones Finales sobre los Modelos Atómicos
Los modelos atómicos no son solo teorías abstractas; son la base de nuestra comprensión del mundo. Nos permiten desentrañar los secretos de la materia y explorar lo que nos rodea a nivel más profundo. Desde las primeras ideas de Demócrito hasta los complejos modelos cuánticos de hoy, la historia de los modelos atómicos es un testimonio del ingenio humano y la curiosidad innata que nos impulsa a descubrir más.
Preguntas Frecuentes
¿Quién fue el primer científico en proponer la idea de los átomos?
La idea de los átomos fue propuesta por el filósofo griego Demócrito en el siglo V a.C., aunque no fue respaldada por evidencia científica hasta mucho después.
¿Qué es el modelo del pudín de pasas?
Es el modelo atómico propuesto por J.J. Thomson, que imaginaba un átomo como una esfera positiva con electrones incrustados en ella, similar a las pasas en un pudín.
¿Cómo se diferencia el modelo cuántico del modelo de Bohr?
El modelo de Bohr propone órbitas fijas para los electrones, mientras que el modelo cuántico sugiere que los electrones se encuentran en nubes de probabilidad y no en órbitas definidas.
¿Por qué son importantes los modelos atómicos en la ciencia moderna?
Los modelos atómicos son fundamentales para comprender la química, la física y la tecnología moderna, permitiendo el desarrollo de nuevos materiales, la energía nuclear y mucho más.