Todo lo que Necesitas Saber sobre la Ley de los Proporciones Definidas
Introducción a la Ley de los Proporciones Definidas
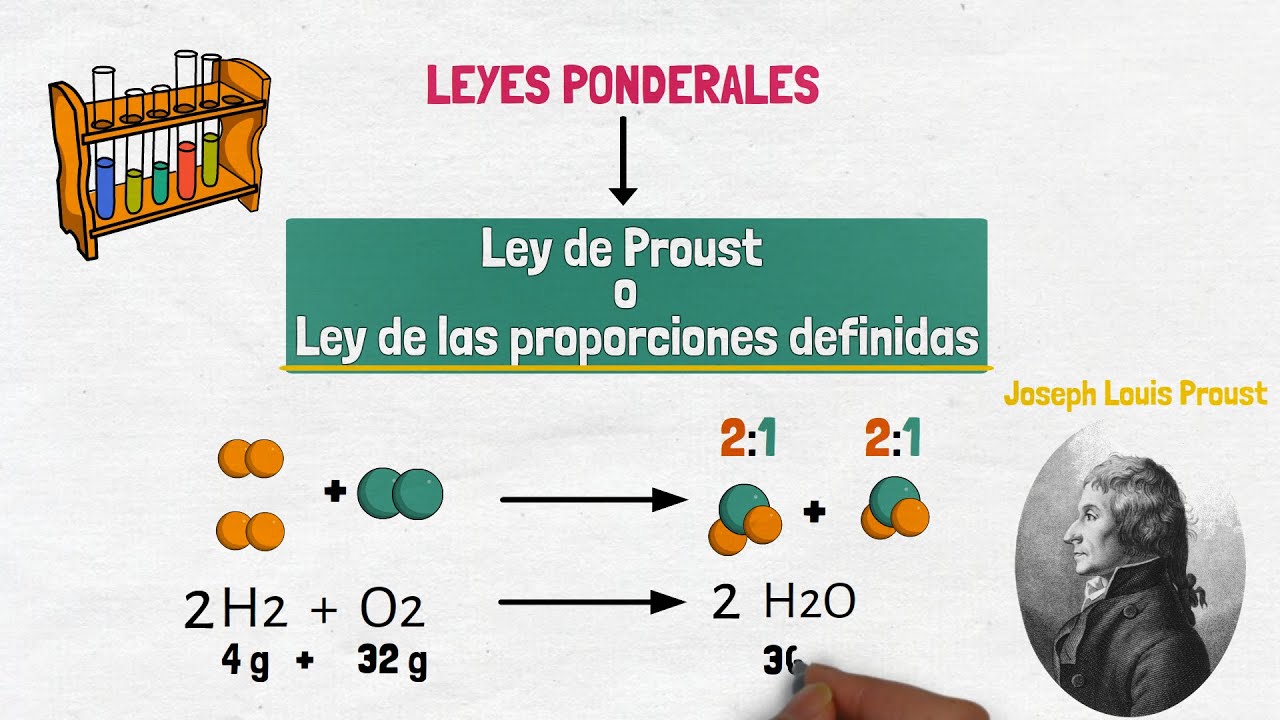
¿Alguna vez te has preguntado por qué ciertos compuestos químicos tienen la misma composición, sin importar su origen? La ley de las proporciones definidas, también conocida como ley de Proust, nos brinda una respuesta fascinante a esta pregunta. En términos simples, esta ley establece que un compuesto químico siempre contiene los mismos elementos en las mismas proporciones en masa, sin importar cómo se haya obtenido. Esto significa que si tomas agua, ya sea de un río, de un grifo o de un laboratorio, siempre tendrá la misma composición: dos átomos de hidrógeno y uno de oxígeno. Pero, ¿qué implica esto realmente para nuestra comprensión de la química y el mundo que nos rodea?
Un Poco de Historia: ¿Quién fue Proust?
Antoine Laurent de Lavoisier, un químico francés, es considerado el padre de la química moderna, pero no podemos hablar de la ley de las proporciones definidas sin mencionar a Joseph Louis Proust. Este científico, también francés, formuló la ley a finales del siglo XVIII. Su trabajo fue fundamental porque ayudó a establecer la idea de que la materia tiene una composición constante y que los elementos que la componen se combinan en proporciones fijas. Proust realizó experimentos meticulosos que demostraron que, independientemente de cómo se preparara un compuesto, la relación entre los elementos que lo formaban siempre era la misma. ¡Imagina descubrir que el agua siempre es agua, sin importar cómo la obtengas!
¿Por qué es Importante la Ley de las Proporciones Definidas?
La ley de las proporciones definidas es crucial por varias razones. Primero, proporciona una base sólida para la química moderna. Si los compuestos no tuvieran una composición constante, sería prácticamente imposible estudiar las reacciones químicas de manera efectiva. Imagina intentar cocinar una receta sin saber cuántos ingredientes necesitas. Sería un desastre, ¿verdad?
Además, esta ley también ayuda a los científicos a comprender la naturaleza de las reacciones químicas. Cuando los elementos se combinan para formar un compuesto, lo hacen en proporciones específicas, lo que significa que podemos predecir cómo se comportarán en diferentes condiciones. Por ejemplo, si sabemos que el agua siempre tiene la misma composición, podemos estudiar cómo se comporta en diferentes temperaturas y presiones, y esto tiene implicaciones en áreas como la meteorología y la climatología.
Ejemplos de la Ley de las Proporciones Definidas
Veamos algunos ejemplos prácticos que ilustran esta ley. Tomemos el dióxido de carbono (CO2) como un caso. Este compuesto siempre se compone de un átomo de carbono y dos átomos de oxígeno. Si un científico toma muestras de dióxido de carbono de diferentes fuentes, ya sea de la atmósfera, de una reacción química o de la combustión de un combustible, siempre encontrará la misma relación: 1:2. Esto es cierto sin importar las condiciones bajo las cuales se obtenga. ¡Es como si el universo tuviera un libro de recetas que siempre se sigue al pie de la letra!
Relación con Otras Leyes de la Química
La ley de las proporciones definidas no está sola en el mundo de la química. Se relaciona con otras leyes fundamentales, como la ley de las proporciones múltiples y la ley de conservación de la masa. La ley de las proporciones múltiples establece que si dos elementos pueden combinarse para formar más de un compuesto, las masas de uno de los elementos que se combinan con una masa fija del otro elemento están en una relación de números enteros simples. Por ejemplo, el carbono y el oxígeno pueden combinarse para formar tanto CO como CO2. Si tomamos una masa fija de carbono, las masas de oxígeno que se combinan con ella para formar estos dos compuestos estarán en una relación simple.
La Ley de Conservación de la Masa
Por otro lado, la ley de conservación de la masa, formulada por Lavoisier, establece que la masa total de los reactivos en una reacción química siempre será igual a la masa total de los productos. Esto se alinea perfectamente con la ley de las proporciones definidas, ya que si los elementos se combinan en proporciones fijas, la masa total de los reactivos debe coincidir con la masa total de los productos, manteniendo el equilibrio en la reacción. Es como una balanza que siempre se mantiene equilibrada, sin importar cómo muevas los pesos.
Aplicaciones Prácticas de la Ley de las Proporciones Definidas
La ley de las proporciones definidas tiene aplicaciones en diversas áreas, desde la industria hasta la investigación científica. En la fabricación de productos químicos, por ejemplo, es fundamental asegurarse de que se utilicen las proporciones correctas de los ingredientes. Si se produce un error en la proporción, el producto final podría ser ineficaz o incluso peligroso. Piensa en la importancia de seguir una receta de cocina al pie de la letra; si agregas demasiado de un ingrediente, el resultado puede ser desastroso.
En el ámbito farmacéutico, esta ley es crucial para la formulación de medicamentos. Cada medicamento tiene una composición específica que debe ser precisa para garantizar su efectividad y seguridad. Si un farmacéutico no respeta las proporciones definidas al mezclar los ingredientes, podría poner en riesgo la salud de los pacientes. Es una responsabilidad enorme que requiere atención al detalle.
Impacto en la Educación y la Investigación
La ley de las proporciones definidas también tiene un impacto significativo en la educación científica. Desde la escuela secundaria hasta la universidad, los estudiantes aprenden sobre esta ley como un pilar fundamental de la química. Comprender esta ley ayuda a los estudiantes a desarrollar un pensamiento crítico y analítico, habilidades que son valiosas no solo en la ciencia, sino en cualquier disciplina. Además, en la investigación científica, esta ley guía a los investigadores en sus experimentos y les ayuda a formular hipótesis y teorías sobre el comportamiento de los compuestos químicos.
¿Qué Ocurre si se Ignora la Ley de las Proporciones Definidas?
Ignorar la ley de las proporciones definidas puede llevar a resultados desastrosos. En la química, si no se respetan las proporciones fijas de los elementos, las reacciones pueden no producir los productos esperados, lo que puede resultar en desperdicio de recursos, productos inseguros o incluso reacciones explosivas. Es como intentar construir una casa sin seguir un plano; el resultado puede ser una estructura inestable y peligrosa.
Además, en la investigación científica, ignorar esta ley puede llevar a conclusiones erróneas. Si un científico no considera las proporciones definidas al analizar sus datos, podría llegar a resultados que no se replican en otros experimentos, lo que socava la credibilidad de la investigación. La ciencia se basa en la reproducibilidad y la precisión, y la ley de las proporciones definidas es un componente esencial de este proceso.
Conclusiones sobre la Ley de las Proporciones Definidas
La ley de las proporciones definidas es una de las piedras angulares de la química moderna. Nos ayuda a entender cómo se combinan los elementos y por qué los compuestos tienen una composición constante. Desde su descubrimiento por Proust hasta sus aplicaciones en la industria y la investigación, esta ley ha demostrado ser fundamental para nuestra comprensión del mundo químico. Al igual que seguir una receta de cocina, respetar las proporciones definidas es crucial para obtener resultados consistentes y predecibles en cualquier experimento o proceso químico.
Así que la próxima vez que uses agua, recuerda que estás tratando con un compuesto que siempre tendrá la misma composición, sin importar de dónde provenga. ¡Eso es ciencia en acción!
Preguntas Frecuentes
- ¿Qué es la ley de las proporciones definidas? La ley establece que un compuesto químico siempre contiene los mismos elementos en las mismas proporciones en masa.
- ¿Cómo se relaciona la ley de las proporciones definidas con otras leyes de la química? Se relaciona con la ley de las proporciones múltiples y la ley de conservación de la masa, que juntas forman la base de la química moderna.
- ¿Por qué es importante seguir las proporciones definidas en la industria? Seguir estas proporciones garantiza la efectividad y seguridad de los productos, evitando errores costosos y peligrosos.
- ¿Qué pasaría si ignoramos esta ley en la investigación científica? Ignorar la ley podría llevar a resultados erróneos y socavar la credibilidad de la investigación, lo que es perjudicial para el avance del conocimiento científico.