Cómo Saber la Masa de un Átomo: Guía Paso a Paso para Entender la Masa Atómica
Introducción a la Masa Atómica
¿Alguna vez te has preguntado qué es lo que realmente compone un átomo y cómo se determina su masa? ¡No te preocupes! Hoy vamos a sumergirnos en el fascinante mundo de la masa atómica. Imagina que un átomo es como una pequeña esfera, compuesta de partículas diminutas que son más pequeñas que un grano de arena. Cada átomo tiene su propia «identidad», y esta se refleja en su masa. Pero, ¿cómo se mide esa masa? ¿Por qué es importante? En esta guía paso a paso, te llevaré a través de los conceptos básicos y avanzados para que comprendas de manera sencilla cómo se calcula la masa de un átomo y qué significa en el contexto de la química y la física. Así que, ¡prepárate para explorar el universo atómico!
¿Qué es la Masa Atómica?
Primero, hablemos de la masa atómica. La masa atómica es un número que representa la masa promedio de los átomos de un elemento, considerando todas sus isótopos y su abundancia relativa. ¿Suena complicado? No te preocupes, es más sencillo de lo que parece. Piensa en la masa atómica como el «peso» de un átomo, pero en una escala que permite compararlo con otros átomos. En el sistema internacional, la masa atómica se mide en unidades de masa atómica (uma o amu), donde un átomo de carbono-12 se define como exactamente 12 uma. ¡Así que cada vez que escuchas un número como 1.008 para el hidrógeno o 16 para el oxígeno, ya sabes que se refiere a su masa atómica!
¿Por qué es Importante Conocer la Masa de un Átomo?
La masa atómica no es solo un número en la tabla periódica; tiene implicaciones en la química, la física y hasta en la biología. ¿Alguna vez has cocinado y te has dado cuenta de que las proporciones de los ingredientes son cruciales? Lo mismo ocurre en la química. Las reacciones químicas dependen de la masa de los reactivos y productos. Si no conoces la masa de un átomo, no puedes predecir cómo interactuará con otros átomos. Además, la masa atómica influye en propiedades como la densidad, el punto de fusión y la reactividad. Así que, sí, conocer la masa de un átomo es fundamental para entender cómo funciona el mundo a nivel molecular.
Pasos para Calcular la Masa de un Átomo
1. Entender la Composición del Átomo
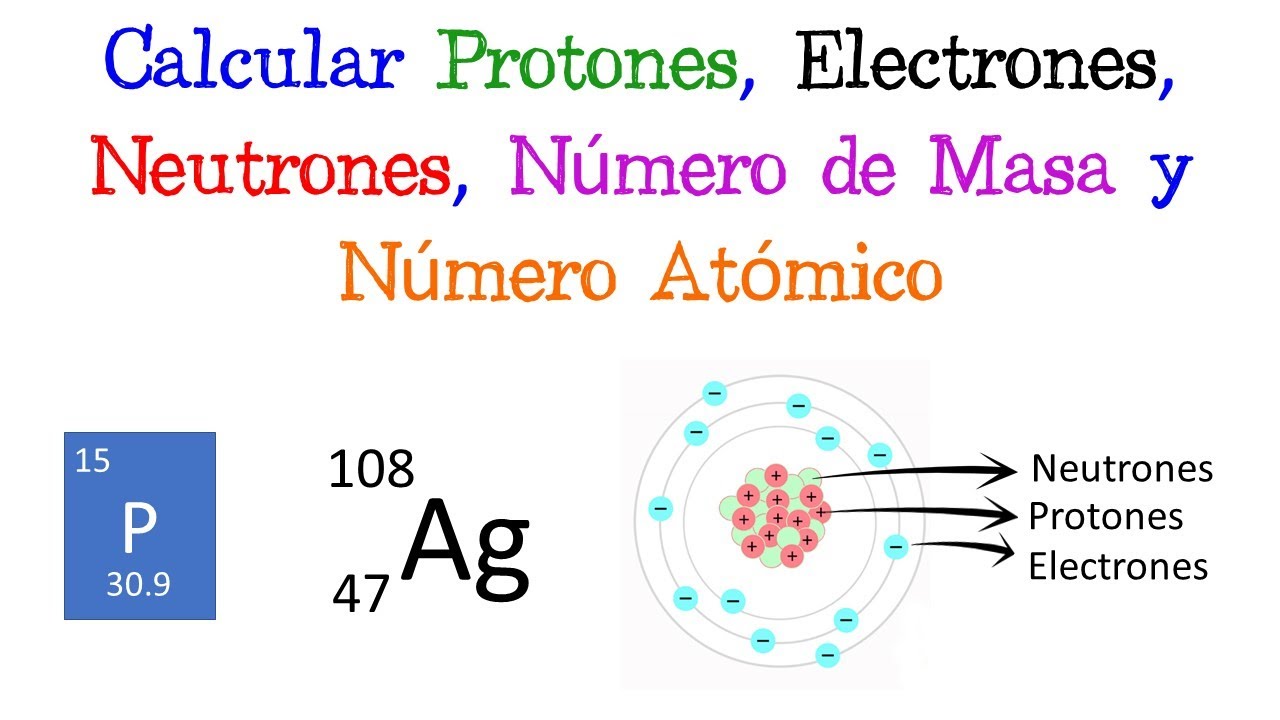
Para calcular la masa de un átomo, primero necesitas conocer sus componentes. Un átomo está formado principalmente por protones, neutrones y electrones. Los protones y neutrones se encuentran en el núcleo, mientras que los electrones orbitan alrededor de este. Aunque los electrones tienen masa, su contribución es tan pequeña que a menudo se ignora en los cálculos de masa atómica. Por lo tanto, cuando hablamos de la masa de un átomo, realmente estamos hablando de la suma de la masa de los protones y neutrones.
2. Conocer el Número de Protonas y Neutrones
El siguiente paso es identificar el número de protones y neutrones en el átomo. El número de protones se conoce como el número atómico y determina qué elemento es. Por ejemplo, el hidrógeno tiene un número atómico de 1 porque tiene un solo protón. El número de neutrones puede variar, dando lugar a isótopos. Por ejemplo, el carbono tiene un número atómico de 6, pero puede tener 6, 7 o 8 neutrones, resultando en isótopos como el carbono-12, carbono-13 y carbono-14.
3. Sumar las Masas de los Protonas y Neutrones
Ahora, vamos a sumar las masas. La masa de un protón es aproximadamente 1.007 uma y la de un neutrón es aproximadamente 1.008 uma. Por lo tanto, si tomamos el carbono-12 como ejemplo, con 6 protones y 6 neutrones, su masa sería:
6 protones x 1.007 uma + 6 neutrones x 1.008 uma = 12.095 uma.
Sin embargo, como el carbono-12 se define como 12 uma, este cálculo nos muestra que la masa atómica es una aproximación que toma en cuenta la variabilidad en la masa de los isótopos.
El Papel de los Isótopos en la Masa Atómica
Los isótopos son variantes de un elemento que tienen el mismo número de protones pero diferente número de neutrones. Esto significa que, aunque sean del mismo elemento, su masa atómica puede variar. Por ejemplo, el carbono-12, carbono-13 y carbono-14 son isótopos del carbono. La masa atómica promedio que ves en la tabla periódica (como 12.01 para el carbono) es un promedio ponderado de las masas de todos los isótopos de ese elemento, considerando su abundancia natural. ¿No es genial? La naturaleza se encarga de equilibrar las masas a través de su propia estadística.
Ejemplo Práctico: Calculando la Masa de un Átomo
Vamos a poner en práctica lo que hemos aprendido. Supongamos que queremos calcular la masa del oxígeno, que tiene 8 protones y normalmente 8 neutrones. La masa de un protón es aproximadamente 1.007 uma y la de un neutrón es aproximadamente 1.008 uma. Así que la masa atómica del oxígeno sería:
8 protones x 1.007 uma + 8 neutrones x 1.008 uma = 16.064 uma.
Esto nos dice que el oxígeno tiene una masa atómica aproximada de 16 uma, que es consistente con lo que encontramos en la tabla periódica.
Factores que Afectan la Masa Atómica
Hay varios factores que pueden influir en la masa atómica de un elemento. Uno de ellos es la existencia de isótopos. Como mencionamos, diferentes isótopos tienen diferentes números de neutrones, lo que afecta su masa. Además, las condiciones bajo las cuales se mide la masa pueden influir en los resultados. Por ejemplo, en condiciones extremas de temperatura y presión, la masa de un átomo puede cambiar ligeramente debido a efectos relativistas. Esto es más relevante en elementos pesados donde la velocidad de los electrones se acerca a la velocidad de la luz.
¿Cómo se Mide la Masa Atómica?
La masa atómica se mide usando técnicas avanzadas como la espectrometría de masas. Este proceso implica ionizar átomos y separarlos en función de su relación masa/carga. Una vez que los átomos son separados, se pueden contar y medir, lo que permite calcular la masa atómica con gran precisión. Es como tener un balanza de alta precisión, pero en lugar de pesar objetos, estás pesando átomos individuales. ¡Increíble, ¿verdad?!
Preguntas Frecuentes
1. ¿La masa atómica de un elemento siempre es un número entero?
No, la masa atómica no siempre es un número entero porque es un promedio ponderado de las masas de todos los isótopos de un elemento, teniendo en cuenta su abundancia relativa. Por eso, elementos como el carbono tienen una masa atómica de 12.01.
2. ¿Por qué los electrones no se consideran en la masa atómica?
Los electrones tienen una masa muy pequeña en comparación con protones y neutrones. Su contribución a la masa total de un átomo es tan pequeña que a menudo se ignora en los cálculos de masa atómica.
3. ¿Qué son los isótopos y por qué son importantes?
Los isótopos son variantes de un elemento que tienen el mismo número de protones pero diferente número de neutrones. Son importantes porque pueden afectar las propiedades químicas y físicas del elemento, así como su comportamiento en reacciones químicas.
4. ¿Cómo afecta la masa atómica a las reacciones químicas?
La masa atómica influye en cómo los átomos interactúan entre sí. En una reacción química, los átomos deben combinarse en proporciones específicas, y conocer la masa atómica es esencial para calcular estas proporciones y predecir los productos de la reacción.
5. ¿Se puede cambiar la masa de un átomo?
La masa de un átomo en sí no se puede cambiar, pero el número de neutrones puede variar, lo que resulta en diferentes isótopos. Además, en reacciones nucleares, los núcleos pueden fusionarse o dividirse, lo que puede cambiar la masa total involucrada.
Así que, ahí lo tienes, una guía completa sobre cómo saber la masa de un átomo. Espero que ahora tengas una mejor comprensión de este tema fascinante y esencial en el mundo de la ciencia. ¡La próxima vez que mires la tabla periódica, recordarás que cada número tiene una historia detrás!