Descubre el Carácter Metálico de los Elementos: Propiedades y Ejemplos Clave
Introducción al Carácter Metálico
¿Alguna vez te has preguntado por qué ciertos elementos son tan diferentes entre sí? La tabla periódica está llena de sorpresas y, entre ellas, el carácter metálico de los elementos destaca como un rasgo fascinante. Pero, ¿qué significa realmente tener un carácter metálico? En términos simples, se refiere a la tendencia de un elemento a exhibir propiedades metálicas, como la conductividad eléctrica, la maleabilidad y el brillo. En este artículo, vamos a sumergirnos en el mundo de los metales, explorar sus propiedades y conocer algunos ejemplos clave que te ayudarán a entender por qué son tan importantes en nuestra vida diaria.
El carácter metálico no es solo un término de química; es un concepto que afecta muchas áreas de nuestra vida. Desde la construcción de edificios hasta la creación de dispositivos electrónicos, los metales son fundamentales. Pero, ¿qué hace que un elemento sea considerado metálico? A medida que nos adentramos en el tema, descubriremos cómo la estructura atómica de un elemento influye en sus propiedades metálicas. Así que, si estás listo, acompáñame en este viaje para descubrir el fascinante mundo del carácter metálico de los elementos.
¿Qué es el Carácter Metálico?
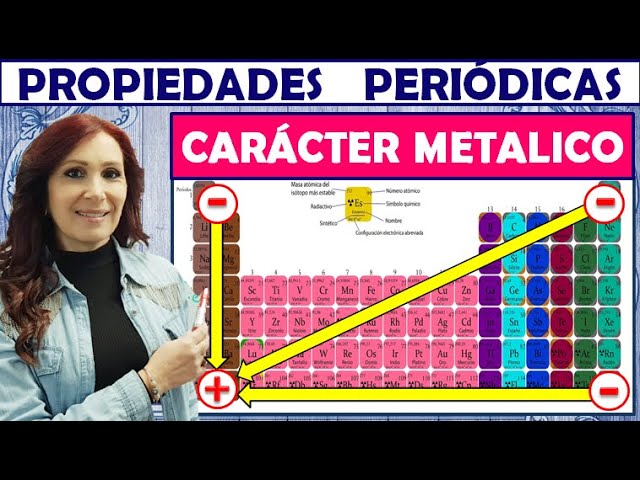
El carácter metálico se refiere a la tendencia de un elemento a comportarse como un metal. Pero, ¿cómo sabemos si un elemento tiene un carácter metálico fuerte o débil? Generalmente, se considera que los elementos que se encuentran en la parte izquierda y en el centro de la tabla periódica, como el sodio (Na) o el hierro (Fe), son más metálicos. Por otro lado, los elementos que se encuentran en la parte derecha, como el oxígeno (O) y el flúor (F), son más no metálicos.
Imagina la tabla periódica como una gran fiesta. En un extremo, tienes a los metales, que son el alma de la fiesta, llenos de energía y siempre listos para interactuar. En el otro extremo, están los no metales, más reservados y un poco distantes. La transición entre ambos grupos se da en una línea diagonal que divide a los metales de los no metales. Esta línea se conoce como la «línea de separación» y es crucial para entender cómo clasificar los elementos.
Propiedades de los Metales
Ahora que sabemos qué es el carácter metálico, vamos a hablar sobre las propiedades que definen a los metales. ¿Por qué son tan especiales? Aquí hay algunas características clave:
1. Conductividad Eléctrica y Térmica: Los metales son excelentes conductores de electricidad y calor. Esto se debe a la estructura de sus electrones, que pueden moverse libremente, permitiendo que la energía fluya sin obstáculos. Imagina un río caudaloso; los electrones son el agua que fluye sin problemas.
2. Maleabilidad y Ductilidad: Los metales pueden ser moldeados en diferentes formas sin romperse. La maleabilidad se refiere a la capacidad de ser aplanados en láminas, mientras que la ductilidad se refiere a la capacidad de ser estirados en hilos. Piensa en el oro, que se puede convertir en finas hojas o en hilos delgados sin perder su integridad.
3. Brillo Metálico: Los metales tienen un brillo característico que les da un aspecto atractivo. Este brillo se debe a la forma en que reflejan la luz. Es como si llevaran una capa de glamour natural.
4. Puntos de Fusión y Ebullición Altos: La mayoría de los metales tienen altos puntos de fusión y ebullición. Esto significa que se requieren temperaturas extremas para cambiarlos de estado. Es como un guerrero resistente que no se rinde fácilmente ante las adversidades.
5. Densidad Alta: Los metales suelen ser densos, lo que significa que tienen una gran masa en relación con su volumen. Esto los hace pesados y robustos, como un tanque en comparación con una pluma.
Ejemplos de Elementos Metálicos
Ahora que hemos cubierto las propiedades de los metales, veamos algunos ejemplos concretos que nos ayudarán a entender mejor este concepto.
1. Hierro (Fe)
El hierro es uno de los metales más utilizados en el mundo. Desde la construcción de rascacielos hasta la fabricación de herramientas, su resistencia y durabilidad lo hacen invaluable. El hierro tiene un carácter metálico fuerte y es conocido por su alta densidad y resistencia a la tracción. Sin embargo, es importante recordar que el hierro también se oxida, lo que significa que puede corroerse si no se cuida adecuadamente. Así que, aunque es fuerte, también necesita un poco de atención.
2. Cobre (Cu)
El cobre es otro metal fascinante, especialmente conocido por su excelente conductividad eléctrica. Es ampliamente utilizado en cables eléctricos y componentes electrónicos. Además, su maleabilidad permite que se forme en diversas formas, desde tubos hasta láminas. ¿Sabías que el cobre también tiene propiedades antimicrobianas? Esto significa que puede ayudar a prevenir la proliferación de bacterias, lo que lo convierte en una opción popular para superficies en hospitales y lugares públicos.
3. Oro (Au)
El oro es el rey de los metales preciosos. Su brillo y maleabilidad lo han convertido en un símbolo de riqueza y estatus a lo largo de la historia. Pero, más allá de su atractivo visual, el oro es un excelente conductor de electricidad y no se oxida fácilmente. Esto lo hace ideal para la fabricación de joyas y componentes electrónicos de alta calidad. ¿Quién no querría tener un poco de oro en su vida?
La Importancia de los Metales en la Vida Diaria
Los metales no son solo un tema de estudio en química; son parte integral de nuestra vida diaria. Desde la tecnología que usamos hasta los alimentos que consumimos, los metales están en todas partes. Pero, ¿por qué son tan importantes?
1. Tecnología y Electrónica
La revolución tecnológica no sería posible sin metales. Elementos como el cobre, el oro y el aluminio son esenciales en la fabricación de dispositivos electrónicos. Piensa en tu teléfono móvil; está lleno de circuitos y componentes que dependen de la conductividad y propiedades de los metales. Sin metales, la tecnología moderna simplemente no existiría.
2. Construcción y Estructuras
Los metales como el acero y el aluminio son fundamentales en la construcción de edificios, puentes y otras infraestructuras. Su resistencia y durabilidad permiten que las estructuras sean seguras y funcionales. ¿Alguna vez has mirado un rascacielos y te has preguntado qué lo sostiene? La respuesta está en los metales.
3. Transporte
Los vehículos que utilizamos para transportarnos, desde coches hasta aviones, dependen en gran medida de los metales. El acero se utiliza en la fabricación de chasis de automóviles, mientras que el aluminio se utiliza en aviones para reducir el peso y mejorar la eficiencia del combustible. Sin metales, nuestro sistema de transporte sería muy diferente.
Factores que Afectan el Carácter Metálico
El carácter metálico de un elemento no es fijo; puede variar en función de varios factores. ¿Cuáles son estos factores? Vamos a explorarlos.
1. Posición en la Tabla Periódica
Como mencionamos anteriormente, la posición de un elemento en la tabla periódica juega un papel crucial en su carácter metálico. Los elementos que están a la izquierda y en el centro suelen ser más metálicos, mientras que los que están a la derecha son más no metálicos. Esta disposición se debe a la configuración electrónica de los átomos.
2. Tamaño Atómico
El tamaño de un átomo también influye en su carácter metálico. A medida que el tamaño atómico aumenta, la tendencia a perder electrones también aumenta. Esto significa que los elementos más grandes tienden a exhibir un carácter metálico más fuerte. Piensa en un elefante: cuanto más grande es, más fácil es para él moverse y hacer ruido.
3. Electronegatividad
La electronegatividad es la medida de la capacidad de un átomo para atraer electrones. Los metales tienen baja electronegatividad, lo que significa que tienden a perder electrones en lugar de ganarlos. Esto los hace más propensos a exhibir propiedades metálicas. Es como si los metales fueran los «donantes» en una relación, mientras que los no metales son los «receptores».
Preguntas Frecuentes
1. ¿Qué elementos son considerados metales?
Los metales incluyen elementos como el hierro, cobre, oro, plata, aluminio y plomo, entre otros. La mayoría de estos se encuentran en la parte izquierda y central de la tabla periódica.
2. ¿Por qué los metales son buenos conductores de electricidad?
Los metales tienen electrones libres que pueden moverse fácilmente, lo que permite que la electricidad fluya a través de ellos sin resistencia.
3. ¿Todos los metales son sólidos a temperatura ambiente?
No, la mayoría de los metales son sólidos a temperatura ambiente, pero el mercurio es un metal que es líquido a temperatura ambiente.
4. ¿Cómo se pueden clasificar los metales?
Los metales se pueden clasificar en metales alcalinos, metales alcalinotérreos, metales de transición, metales post-transitionales y metales raros, entre otros.
5. ¿Cuál es el metal más abundante en la Tierra?
El aluminio es el metal más abundante en la corteza terrestre, y se utiliza en una variedad de aplicaciones debido a su ligereza y resistencia a la corrosión.
En resumen, el carácter metálico de los elementos es un tema apasionante que va más allá de la química. Los metales son fundamentales para nuestra vida diaria y entender sus propiedades y ejemplos nos ayuda a apreciar el mundo que nos rodea. Así que la próxima vez que veas un objeto metálico, recuerda que hay una historia fascinante detrás de su existencia. ¿Cuál es tu metal favorito y por qué?