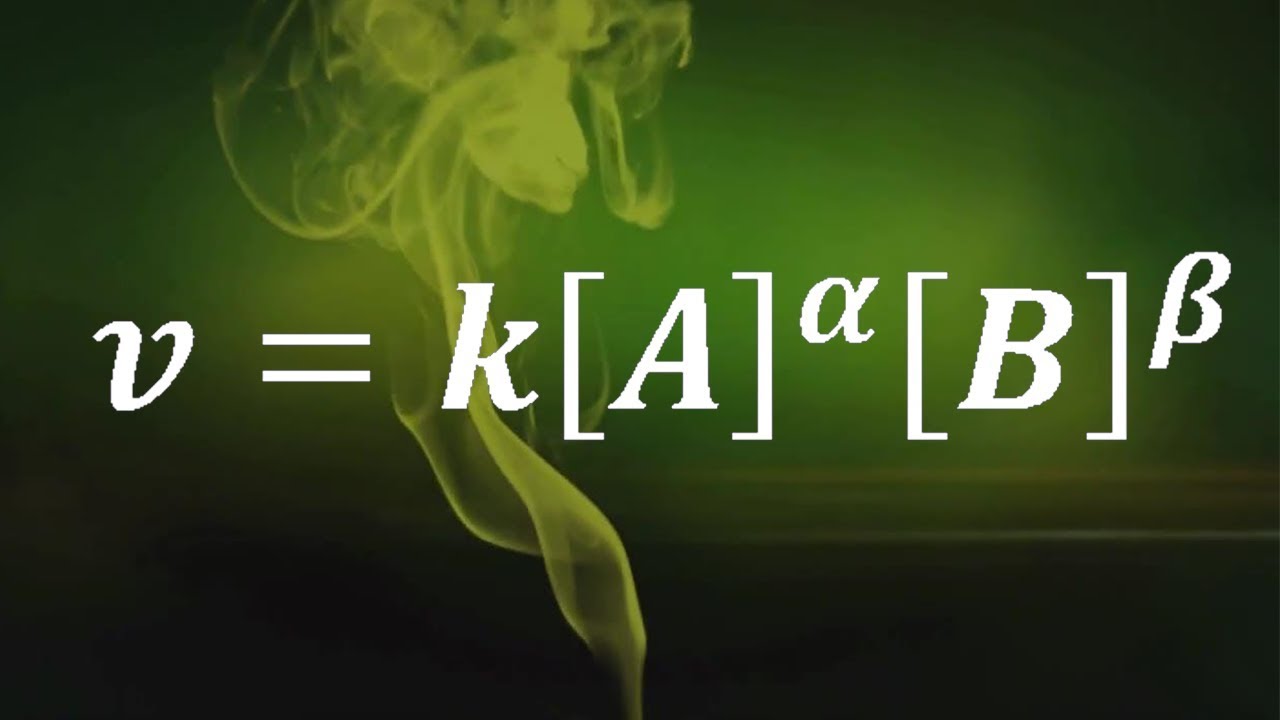Cómo Saber el Orden de una Reacción: Guía Paso a Paso para Estudiantes de Química
Introducción al Orden de Reacción
Entender el orden de una reacción química es como tener la clave maestra para descifrar el comportamiento de los reactivos en una reacción. ¿Alguna vez te has preguntado por qué algunas reacciones son rápidas mientras que otras parecen llevar una eternidad? El orden de reacción no solo nos dice cuán rápido ocurrirá una reacción, sino que también nos da pistas sobre la relación entre la concentración de los reactivos y la velocidad de la reacción. ¡Vamos a desglosar esto paso a paso!
¿Qué es el Orden de una Reacción?
El orden de una reacción se refiere a la relación entre la velocidad de la reacción y las concentraciones de los reactivos. Imagina que estás cocinando; si agregas más ingredientes, probablemente cambiará el tiempo de cocción. En química, la misma lógica se aplica. El orden puede ser 0, 1, 2, o incluso fraccionario. Por ejemplo, en una reacción de primer orden, si duplicas la concentración de un reactivo, la velocidad de reacción también se duplica. Por otro lado, en una reacción de segundo orden, duplicar la concentración cuadruplica la velocidad. ¿Sorprendente, verdad?
Clasificación del Orden de Reacción
1. Orden cero (0): Aquí, la velocidad de la reacción es independiente de la concentración de los reactivos. Es como si tuvieras un coche que va a la misma velocidad sin importar cuánta gasolina le pongas. Un ejemplo clásico es la descomposición de peróxido de hidrógeno en presencia de catalizadores.
2. Orden primero (1): La velocidad de la reacción es directamente proporcional a la concentración de un solo reactivo. Piensa en una carrera: si uno de los corredores se acelera, la carrera será más rápida. Un ejemplo sería la descomposición de un compuesto radiactivo.
3. Orden segundo (2): Aquí, la velocidad es proporcional al cuadrado de la concentración de un reactivo, o a la concentración de dos reactivos. Es como si tuvieras que poner dos veces más esfuerzo para obtener el mismo resultado. Un ejemplo es la reacción entre dos moléculas de un gas que se combinan para formar un líquido.
Cómo Determinar el Orden de una Reacción
Ahora que sabemos qué es el orden de una reacción, la pregunta es: ¿cómo lo determinamos? Aquí hay un enfoque paso a paso que puedes seguir.
Paso 1: Realiza Experimentos de Velocidad
La primera etapa para determinar el orden de una reacción es realizar experimentos. Necesitas medir la velocidad de la reacción a diferentes concentraciones de reactivos. Esto puede ser un poco tedioso, pero es esencial. Imagina que estás tratando de averiguar cómo afecta el azúcar a la velocidad de disolución en agua; tendrías que probar con diferentes cantidades de azúcar y medir cuánto tiempo tarda en disolverse.
Paso 2: Registra Datos y Grafica
Una vez que tengas tus datos, el siguiente paso es organizarlos. Puedes hacer una tabla con las concentraciones de los reactivos y las velocidades de reacción. Luego, grafica estos datos. Dependiendo del orden que sospeches que tiene la reacción, puedes graficar diferentes formas:
– Para reacciones de orden cero, grafica la concentración frente al tiempo.
– Para orden primero, grafica el logaritmo de la concentración frente al tiempo.
– Para orden segundo, grafica el inverso de la concentración frente al tiempo.
Paso 3: Analiza la Gráfica
Después de graficar, observa las líneas resultantes. Si obtienes una línea recta al graficar la concentración frente al tiempo, es probable que sea de orden cero. Si la línea recta aparece al graficar el logaritmo de la concentración, es de primer orden. Y si la línea es recta al graficar el inverso de la concentración, ¡tienes una reacción de segundo orden!
Ejemplo Práctico
Imagina que estás en un laboratorio y decides estudiar la reacción entre el ácido clorhídrico y el carbonato de sodio. Comienzas a medir la velocidad de la reacción a diferentes concentraciones de HCl. Los datos son fascinantes: a medida que aumentas la concentración de HCl, la velocidad de efervescencia (burbujas) también aumenta.
Realizas tus gráficos y, al final, descubres que la gráfica de logaritmo de la concentración de HCl versus tiempo es una línea recta. ¡Eureka! Has determinado que la reacción es de primer orden.
Factores que Afectan el Orden de una Reacción
Es importante mencionar que el orden de una reacción no es algo fijo. Puede variar dependiendo de varios factores, como la temperatura, la presión y la presencia de catalizadores. Piensa en una fiesta; si añades más invitados (catalizadores), la energía y la velocidad de las interacciones aumentan. Así que, si alguna vez te preguntas por qué una reacción puede comportarse de manera diferente en condiciones distintas, ¡ya tienes la respuesta!
Influencia de la Temperatura
La temperatura puede afectar tanto la velocidad como el orden de una reacción. A temperaturas más altas, las moléculas se mueven más rápido y chocan con más frecuencia, lo que puede aumentar la velocidad de la reacción. Sin embargo, en algunos casos, también puede cambiar el mecanismo de reacción, lo que a su vez podría alterar el orden.
Papel de los Catalizadores
Los catalizadores son como esos amigos que te ayudan a hacer las cosas más rápido. Aceleran las reacciones sin ser consumidos en el proceso. Sin embargo, no cambian el orden de la reacción, sino que afectan la energía de activación. Esto significa que, aunque la velocidad de la reacción aumente, el orden permanecerá constante.
Aplicaciones del Orden de Reacción
Conocer el orden de una reacción no es solo una curiosidad académica; tiene aplicaciones prácticas en la vida real. Desde la fabricación de medicamentos hasta la producción de alimentos, entender cómo y por qué ocurren las reacciones es crucial.
Industria Farmacéutica
En la industria farmacéutica, el orden de reacción es fundamental para el diseño y la producción de medicamentos. Los científicos necesitan saber cuán rápido se descompondrán los compuestos activos para garantizar la efectividad de un medicamento a lo largo de su vida útil.
Industria Alimentaria
En la industria alimentaria, entender el orden de reacción puede ayudar a optimizar procesos como la fermentación y la conservación de alimentos. Por ejemplo, saber cómo la temperatura y la concentración de los ingredientes afectan la velocidad de fermentación puede mejorar la calidad del producto final.
Conclusión
Entender el orden de una reacción es esencial para cualquier estudiante de química. Nos permite predecir y controlar las velocidades de reacción, lo cual es crucial en muchas aplicaciones científicas y industriales. Ahora que has pasado por esta guía paso a paso, te invito a que te sumerjas en tus experimentos y apliques este conocimiento. Recuerda, la química es como una aventura: ¡cada reacción es una historia esperando a ser contada!
Preguntas Frecuentes
¿Puedo determinar el orden de una reacción sin realizar experimentos?
No es posible determinar el orden de una reacción sin realizar experimentos, ya que se basa en la observación de la velocidad de reacción bajo diferentes concentraciones de reactivos.
¿El orden de reacción puede ser fraccionario?
Sí, en algunas reacciones, el orden puede ser fraccionario, lo que indica una relación más compleja entre la concentración de los reactivos y la velocidad de la reacción.
¿Qué sucede si hay múltiples reactivos en una reacción?
Cuando hay múltiples reactivos, el orden total de la reacción se calcula sumando los órdenes individuales de cada reactivo. Esto se puede determinar a través de experimentos y análisis gráficos.
¿Cómo afecta la presión al orden de reacción?
En reacciones gaseosas, la presión puede influir en la concentración de los reactivos. Aumentar la presión puede aumentar la velocidad de reacción, pero no necesariamente cambia el orden de la misma.
¿Qué son los mecanismos de reacción y cómo se relacionan con el orden de reacción?
Los mecanismos de reacción son las etapas a través de las cuales ocurre una reacción química. El orden de reacción puede reflejar el mecanismo subyacente, ya que diferentes pasos pueden tener diferentes órdenes.