Descubre la Ley de las Proporciones Definidas de Proust: Fundamentos y Ejemplos Clave
Introducción a la Ley de las Proporciones Definidas
¿Alguna vez te has preguntado por qué los compuestos químicos siempre parecen tener la misma composición, sin importar de dónde provengan? Esta curiosidad nos lleva a la Ley de las Proporciones Definidas, formulada por el químico francés Joseph Proust a principios del siglo XIX. En términos simples, esta ley establece que un compuesto químico siempre está compuesto por los mismos elementos en proporciones fijas. Pero, ¿por qué es esto tan importante? Imagina que estás preparando un delicioso pastel. Si siempre usas la misma cantidad de harina, azúcar y huevos, obtendrás el mismo sabor y textura, ¿verdad? Lo mismo ocurre en la química: las proporciones definidas aseguran que los compuestos mantengan sus características únicas.
En este artículo, exploraremos a fondo la Ley de las Proporciones Definidas de Proust. Hablaremos de su historia, su importancia en la química moderna y algunos ejemplos clave que ilustran cómo funciona esta ley en la práctica. Así que, siéntate cómodo y acompáñame en este fascinante viaje por el mundo de la química, donde las proporciones son la clave para entender la materia.
La Historia Detrás de la Ley de Proust
La historia de la Ley de las Proporciones Definidas comienza en un contexto muy interesante. A finales del siglo XVIII y principios del XIX, la química estaba en pleno desarrollo. Los científicos estaban comenzando a desentrañar los secretos de los elementos y los compuestos, pero había mucha confusión. Diferentes investigadores estaban llegando a diferentes conclusiones sobre cómo se combinaban los elementos. En medio de este caos, Joseph Proust emergió con su idea innovadora.
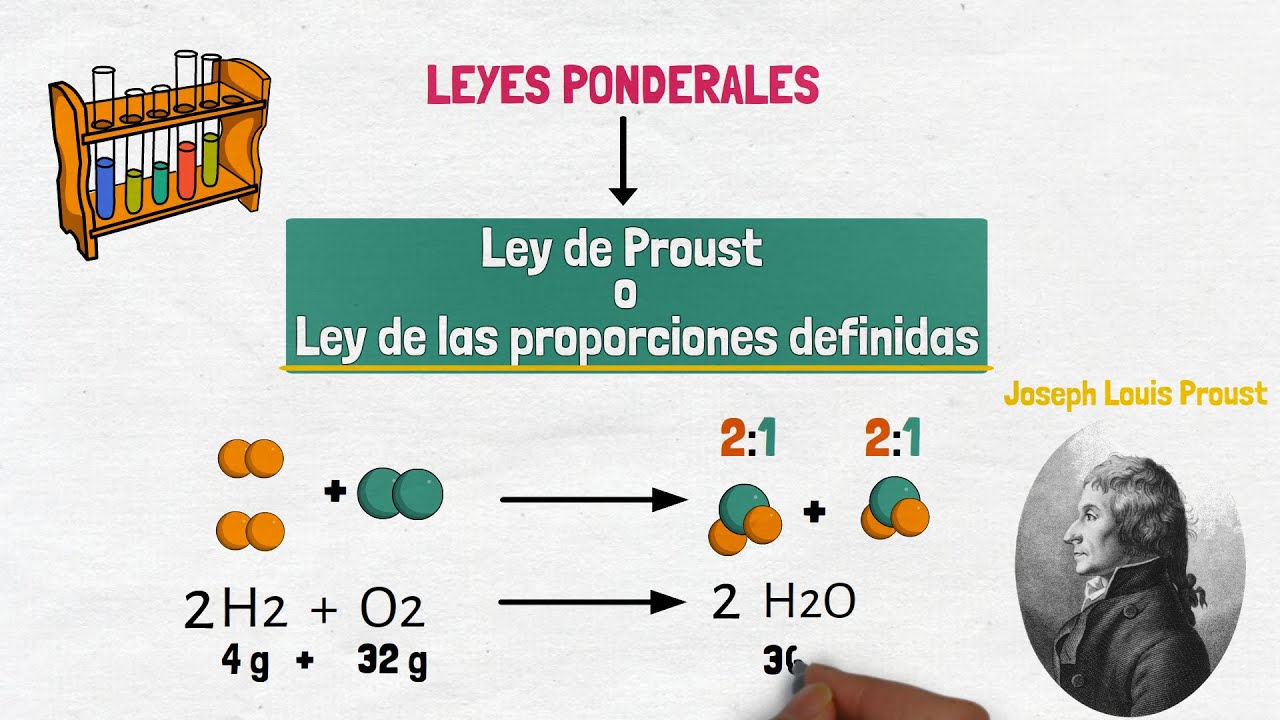
Proust realizó numerosos experimentos y observó que, al combinar elementos para formar compuestos, las proporciones de los elementos eran siempre las mismas. Por ejemplo, al combinar hidrógeno y oxígeno para formar agua, siempre encontró que la proporción era de dos átomos de hidrógeno por cada átomo de oxígeno. Esta observación fue un hito, ya que sentó las bases para la química moderna y ayudó a establecer la idea de que los compuestos tienen una composición química fija.
El Impacto de la Ley de Proust en la Química
La Ley de las Proporciones Definidas no solo fue un avance teórico; tuvo un impacto práctico en la forma en que los científicos trabajaban. Antes de Proust, muchos químicos estaban más enfocados en la teoría del flogisto y otras ideas que ahora consideramos obsoletas. Pero la claridad que trajo Proust permitió que la química se convirtiera en una ciencia más precisa y cuantitativa. Esto, a su vez, abrió las puertas para que otros científicos, como John Dalton, desarrollaran la teoría atómica, que es fundamental para nuestra comprensión de la materia hoy en día.
Imagina que estás armando un rompecabezas. Cada pieza representa un elemento y, cuando se ensamblan en las proporciones correctas, crean una imagen coherente. La Ley de Proust nos dice que, si seguimos las proporciones adecuadas, siempre obtendremos la misma imagen, sin importar cuántas veces lo intentemos. Esta idea ha sido crucial para el desarrollo de la química como una disciplina científica rigurosa.
Ejemplos Clave de la Ley de Proust
Ahora que hemos establecido la importancia de la Ley de las Proporciones Definidas, es momento de ver algunos ejemplos concretos que nos ayudarán a entender mejor esta ley.
El Agua: H₂O
Uno de los ejemplos más conocidos es el agua. Como mencionamos antes, el agua se compone de dos átomos de hidrógeno (H) y uno de oxígeno (O), lo que se representa como H₂O. No importa si tomas agua de un río, un lago o del grifo, siempre que esté en su forma pura, la proporción será la misma. Esto significa que, independientemente de su origen, el agua siempre tendrá las mismas propiedades físicas y químicas. ¡Es un verdadero milagro de la naturaleza!
El Dióxido de Carbono: CO₂
Otro gran ejemplo es el dióxido de carbono. Este gas, que es fundamental para la vida en la Tierra, está formado por un átomo de carbono (C) y dos átomos de oxígeno (O), representado como CO₂. Al igual que el agua, el dióxido de carbono siempre tendrá esta misma proporción, sin importar cómo se produzca. Ya sea a través de la respiración de los seres vivos o la combustión de combustibles fósiles, la composición permanece constante.
La Sal: NaCl
La sal común, o cloruro de sodio, también es un excelente ejemplo de la Ley de Proust. Este compuesto está formado por un átomo de sodio (Na) y un átomo de cloro (Cl), lo que lo representa como NaCl. Cuando piensas en la sal, probablemente te imaginas el condimento que usas en la cocina, pero es fascinante saber que, sin importar su fuente (ya sea de minas o del mar), la composición química de la sal siempre será la misma.
La Relevancia de la Ley de Proust en la Química Moderna
La Ley de las Proporciones Definidas sigue siendo relevante en la química moderna. En un mundo donde la química juega un papel crucial en la medicina, la tecnología y el medio ambiente, comprender cómo se combinan los elementos y en qué proporciones es esencial. Esto no solo se aplica a los compuestos que utilizamos en nuestra vida diaria, sino también en el desarrollo de nuevos materiales y medicamentos.
La Química en la Industria Farmacéutica
En la industria farmacéutica, por ejemplo, la Ley de Proust es fundamental. Cuando los químicos diseñan un nuevo medicamento, deben asegurarse de que los ingredientes activos se combinen en proporciones específicas para que el fármaco sea eficaz y seguro. Un pequeño cambio en la proporción podría significar la diferencia entre un medicamento que cura y uno que causa efectos secundarios peligrosos. Así que, la próxima vez que tomes una pastilla, recuerda que hay toda una ciencia detrás de esa pequeña tableta.
Desarrollo de Nuevos Materiales
Además, en el desarrollo de nuevos materiales, como plásticos o aleaciones metálicas, la comprensión de las proporciones es crucial. Los científicos deben equilibrar las propiedades de diferentes elementos para crear un material que cumpla con requisitos específicos, como resistencia, flexibilidad o conductividad. De nuevo, la Ley de Proust les proporciona una base sólida sobre la que trabajar.
Preguntas Frecuentes
¿Qué es la Ley de las Proporciones Definidas?
La Ley de las Proporciones Definidas, formulada por Joseph Proust, establece que un compuesto químico siempre está formado por los mismos elementos en proporciones fijas, independientemente de su origen.
¿Por qué es importante esta ley en la química?
Es fundamental porque proporciona una base para entender cómo se combinan los elementos y cómo se forman los compuestos. Esto ha permitido que la química se desarrolle como una ciencia precisa y cuantitativa.
¿Cuáles son algunos ejemplos de la Ley de Proust en acción?
Ejemplos clásicos incluyen el agua (H₂O), el dióxido de carbono (CO₂) y la sal (NaCl), todos los cuales tienen proporciones fijas de sus elementos constituyentes.
¿Cómo se aplica la Ley de Proust en la vida cotidiana?
Se aplica en la cocina, la industria farmacéutica y el desarrollo de nuevos materiales, donde las proporciones de los ingredientes son cruciales para obtener resultados consistentes y seguros.
¿Esta ley tiene alguna limitación?
La Ley de Proust se aplica a compuestos químicos definidos, pero no se aplica a mezclas, donde las proporciones pueden variar. Por ejemplo, el aire es una mezcla de varios gases en proporciones variables.
Al final del día, la Ley de las Proporciones Definidas de Proust es un recordatorio de que, en la química, como en la vida, a veces las proporciones correctas son la clave para obtener resultados exitosos. Así que la próxima vez que uses una receta o pienses en la composición de un compuesto, recuerda a Proust y su contribución a la ciencia. ¿Quién diría que las proporciones podrían ser tan fascinantes?